精度达原子级,基于深度学习的动态蛋白质设计: 深度学习推动了静态蛋白质结构的设计。不过天然信号蛋白拥有一些受控的动态构象,从头设计这类蛋白质仍然是一项挑战。 ……
哈喽!伙伴们,我是小智,你们的AI向导。欢迎来到每日的AI学习时间。今天,我们将一起深入AI的奇妙世界,探索“精度达原子级,基于深度学习的动态蛋白质设计”,并学会本篇文章中所讲的全部知识点。还是那句话“不必远征未知,只需唤醒你的潜能!”跟着小智的步伐,我们终将学有所成,学以致用,并发现自身的更多可能性。话不多说,现在就让我们开始这场激发潜能的AI学习之旅吧。
精度达原子级,基于深度学习的动态蛋白质设计:
深度学习推动了静态蛋白质结构的设计。不过天然信号蛋白拥有一些受控的动态构象,从头设计这类蛋白质仍然是一项挑战。
加州大学的研究团队提出了一种通用的深度学习引导方法,用于从头设计蛋白质结构域内几何构象的动态变化(类似于自然界中普遍存在的「开关机制」),且精度达到原子级。
使用这种方法,科学家可以通过从头设计来「定制」蛋白质的新「运动模式」。这为从头构建受生物学启发、可调控和可控的蛋白质信号传导行为提供了一个框架。
该研究以「Deep learning–guided design of dynamic proteins」为题,于 2025 年 5 月 22 日发布在《Science》。

这是一种设计动态蛋白质的通用方法,它利用深度学习在多状态设计过程中指导序列和结构空间的搜索。该方法的一个关键要素是限制搜索空间,首先通过计算机模拟突变扫描确定定义每个用户指定构象状态所需的最小残基集。
具体来说,研究人员评估点突变是否会增加状态间的序列同一性,从而扰乱计算预测的结构。通过集中采样那些对确定状态偏好至关重要的位置,科学家可以生成具有高相似性但状态群体分布各异的序列。
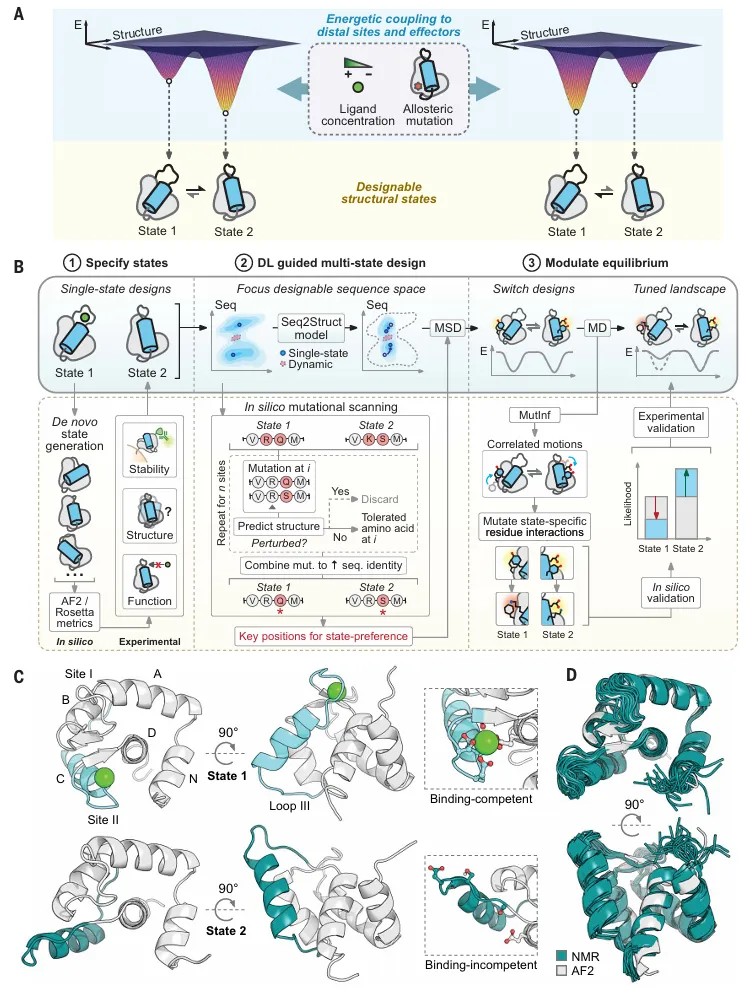
图示:深度学习指导的动态蛋白质设计的通用方法。(来源:论文)
这种方法不仅可以设计出能够在功能相关的时间尺度(即低微秒级)内在预设状态之间切换的蛋白质开关,还能设计出一种通过最小的序列改变来调节构象平衡的机制。不同设计之间共享的序列背景有助于揭示微小的序列差异如何在生物物理层面上改变构象整体。
研究团队通过大量的实验动力学分析以及核磁共振波谱解析的四种结构,验证了他们的预测,并确认了该设计达到原子精度。他们发现,仅仅一个序列位置上的氨基酸身份就能显著改变状态分布,范围从高度倾斜到大致相等。
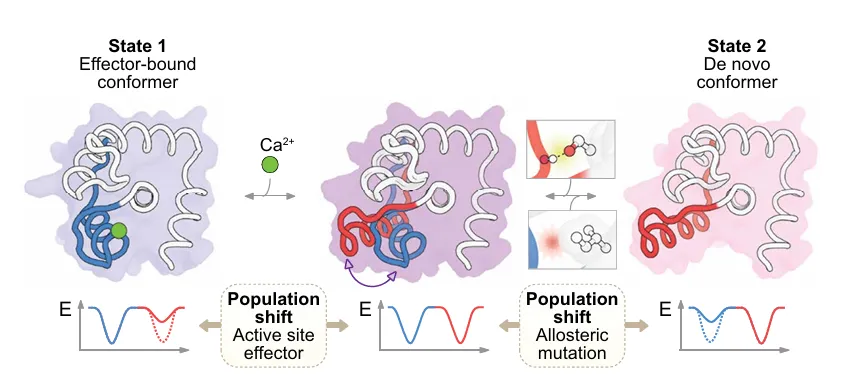
图示:设计具有可控运动的动态蛋白质,模仿自然信号开关中的机制。(来源:论文)
研究人员还通过在设计的动态区域内插入一个 Ca2+ 结合位点(该位点仅在两种状态中的一种状态下呈现结合能力构象)来展示通过 Ca2+ 浓度来调节构象变化。反过来,该团队证明了远端突变调节构象平衡对 Ca2+ 结合亲和力的变构效应。
有一个值得注意的发现是,基于深度学习的预测、实验数据和基于物理的模拟之间存在高度的一致性。这种一致性为开关双稳态的潜在机制提供了可验证的假设,并使科学家能够在原子水平上调控构象平衡。
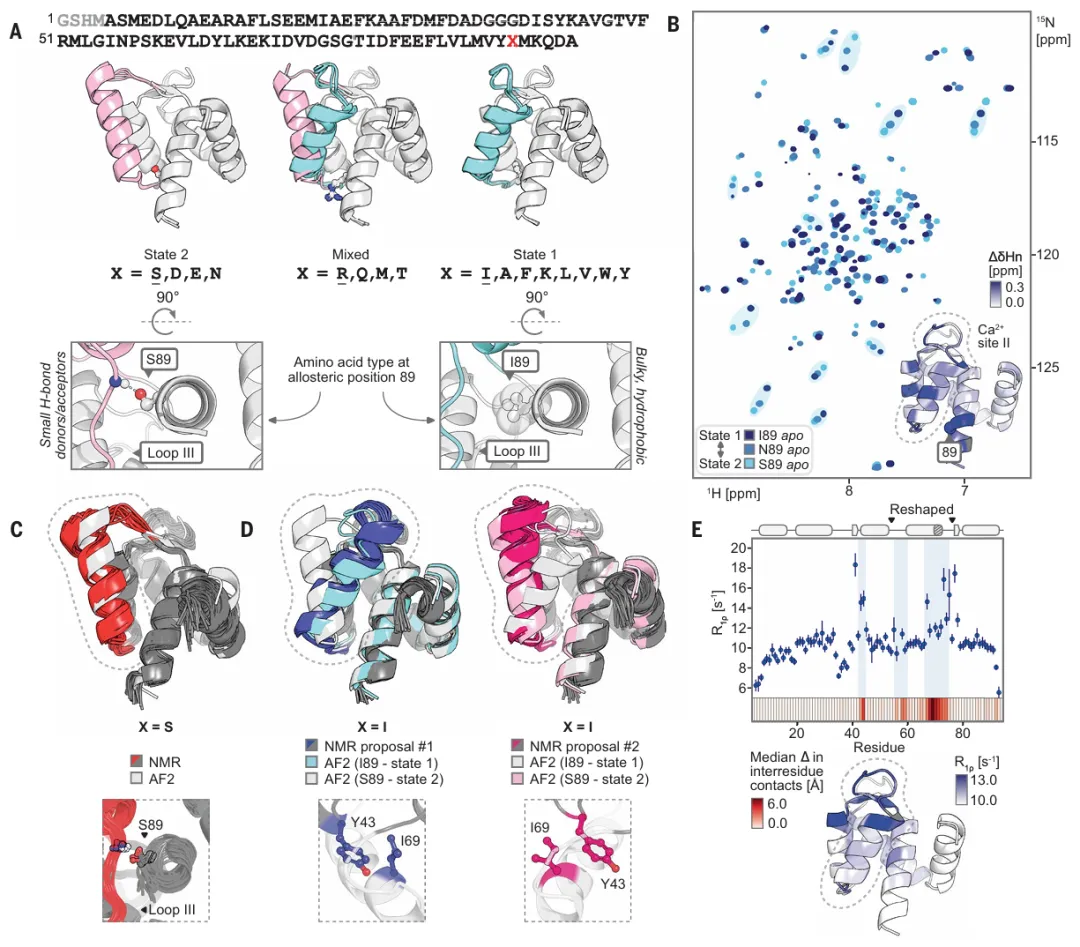
图示:由于变构突变,快速交换中的双态平衡发生了改变。(来源:论文)
该团队将这些发现至少部分归因于他们方法的特定特征,特别是通过序列和结构空间的搜索,将可设计位置缩小到预测为工程构象变化的强决定因素的位置。
基于深度学习的蛋白质序列设计和结构预测所提供的速度和推理能力,使得这种方法最终能够设计出不同的残基网络来稳定两种结构状态。这种对设计系统的深入洞察对于推进变构调控的从头设计至关重要。
深度学习和基于物理的模拟之间的协同作用(例如动态蛋白质的从头设计)可能有助于开发未来的设计方法,从而实现对构象景观和交换时间尺度的预测控制。
未来,深度学习与实验和模拟提供的独特动力学数据相结合,有望实现一次性构象系统预测。此类模型最终可用于设计完整的用户自定义构象图景。
令人鼓舞的是,虽然用于序列和结构预测的单个模型从未针对此类任务进行过明确的训练,但该团队的方法已经能够成功设计涉及状态间残基间相互作用网络复杂变化的运动。
嘿,伙伴们,今天我们的AI探索之旅已经圆满结束。关于“精度达原子级,基于深度学习的动态蛋白质设计”的内容已经分享给大家了。感谢你们的陪伴,希望这次旅程让你对AI能够更了解、更喜欢。谨记,精准提问是解锁AI潜能的钥匙哦!如果有小伙伴想要了解学习更多的AI知识,请关注我们的官网“AI智研社”,保证让你收获满满呦!



 微信扫一扫
微信扫一扫  支付宝扫一扫
支付宝扫一扫 















还没有评论呢,快来抢沙发~